Finalidade da validação e rastreabilidade
O objetivo da validação é garantir que um processo ou sistema seja consistente e documentado. A validação do sistema é uma exigência dos órgãos reguladores. Para organizações de ciências biológicas, por exemplo, as agências reguladoras incluem a Administração de Alimentos e Medicamentos dos Estados Unidos (FDA).
A FDA define validação da seguinte forma:
Confirmação, através de exame e fornecimento de provas objetivas, de que os requisitos específicos para uma utilização específica pretendida podem ser cumpridos de forma consistente.
A Organização Mundial da Saúde (OMS) define validação como segue em suas orientações sobre os requisitos para boas práticas de fabricação (BPF):
Estabelecimento de evidências documentais que forneçam um alto grau de garantia de que um processo planejado estará uniformemente de acordo com os resultados especificados esperados.
Estas definições têm em comum os seguintes elementos, de acordo com os resultados esperados:
- Geração de evidências
- Conformidade com regulamentos
- Cumprimento de requisitos
A validação de sistemas informatizados é um processo documentado para garantir que o sistema faça exatamente o que foi projetado para fazer, de forma consistente e reprodutível. A validação garante a integridade e a segurança do processamento de dados, a qualidade do produto e a conformidade com os regulamentos que se aplicam às Boas {industry} Práticas (GxP).
O processo de validação de um sistema informatizado é descrito em procedimentos operacionais padrão (SOP) e diretrizes criadas e definidas pela indústria regulamentada, como organizações de ciências biológicas. Para a validação de sistemas informatizados, é útil visualizar a implementação do processo como um projeto, conforme descrito na Sociedade Internacional de Engenharia Farmacêutica (ISPE) Boas Práticas de Fabricação Automatizada (GAMP) 5: Uma abordagem baseada em riscos para sistemas informatizados em conformidade com GxP.
Antes de iniciar o projeto de implementação, um plano de alto nível para a nova solução deve estar em vigor. Em seguida, inicie o projeto completando as seguintes fases:
- Planejamento: Nesta fase, os requisitos e especificações devem ser claros o suficiente para uma avaliação inicial de riscos e, em última instância, para uma correta definição dos testes (protocolos) de verificação. Durante esta fase, você entrega o documento do plano de validação que define toda a estratégia de validação e todos os resultados. A estratégia deve estar de acordo com o sistema de gestão da qualidade (SGQ) e as políticas.
- Especificação, configuração e codificação: Durante esta fase, todas as especificações do projeto são feitas no nível de detalhe exigido pelo tipo de sistema e seu uso. Os desenvolvedores escolhem e usam os métodos e objetos de desenvolvimento mais apropriados aos requisitos de codificação e configuração e com base nas especificações aprovadas. Todas essas atividades são realizadas no ambiente de desenvolvimento. Durante esta fase, os testes são mais focados na verificação das unidades ou recursos do ponto de vista do desenvolvedor. Exemplos de atividades de teste incluem testes unitários, testes estatísticos de código e testes de integração. As ferramentas podem automatizar essas atividades de teste.
- Teste: Esta fase confirma que as especificações foram atendidas por meio de inspeções e testes do sistema. As atividades de teste são realizadas em um ambiente de teste preparado e adequado. O ambiente de teste deve ser semelhante ao ambiente de produção para garantir que as condições sejam as mesmas e que não seja necessário repetir os testes no ambiente de produção. O risco deve orientar o escopo do esforço de teste. A análise de risco pode ajudá-lo a compreender os perigos potenciais que podem ter impacto na qualidade do produto, na segurança do paciente ou na integridade dos dados. Esses riscos potenciais devem ser mitigados por meio de controles implementados e comprovação de testes. Se houver um alto risco em algum lugar, tenha cenários de teste apropriados para provar que o design da solução não apresenta falhas potenciais.
- Relatório e liberação: Nesta fase, o sistema deve ser aceitável para uso no ambiente de produção de acordo com um processo documentado e controlado. No encerramento do projeto, uma conclusão de validação do sistema deve ser preparada para resumir as atividades que foram realizadas e quaisquer desvios do plano de validação. A validação do sistema deve ser concluída antes que o sistema seja liberado para uso.
A ilustração a seguir mostra o modelo V compatível com GAMP 5, 2ª edição. Ele fornece uma boa maneira geral de visualizar as fases do projeto.
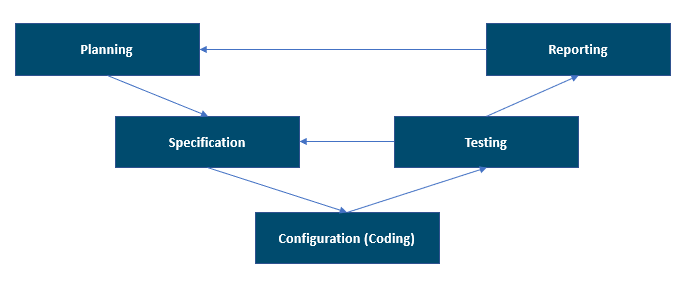
O modelo V pode ser visto não apenas como as atividades de desenvolvimento e teste do sistema, mas também sua sequência, suas inter-relações e o processo de validação das entregas que são aplicáveis ao sistema informatizado validado. Você deve manter e manter inter-relacionamentos entre requisitos, especificações e testes. Essa inter-relação está documentada na Matriz de Rastreabilidade utilizada nas áreas regulamentadas.
A Matriz de Rastreabilidade garante que:
- Os requisitos são atendidos pelo design da solução. Em outras palavras, cada requisito é atribuído às funções, controles, configurações ou elementos de design.
- Os requisitos são testados ou verificados para demonstrar que o design da solução atende aos requisitos, conforme apropriado.
A Matriz de Rastreabilidade traz os seguintes benefícios:
- Ele apóia a revisão do projeto.
- Ajuda a definir o escopo do teste de regressão.
- Fornece suporte durante atividades de inspeção ou auditoria.
- Ele fornece suporte para possíveis mudanças.
Qualificação da plataforma
As indústrias regulamentadas devem qualificar o Microsoft Power Platform como infraestrutura antes de implementarem os Guias. A qualificação da plataforma requer, no mínimo, as seguintes tarefas:
Avaliação inicial de risco (avaliação da aplicabilidade GxP)
Avaliação do fornecedor (auditoria de um fornecedor, seja virtual, físico ou postal)
Plano de qualificação
Especificação técnica de projeto de plataforma
Avaliação de risco (por exemplo, avaliação do risco de disponibilizar aos operadores a versão errada de um guia)
Teste:
- Teste de instalação (por exemplo, testar se os ambientes estão instalados corretamente)
- Testes operacionais (por exemplo, testar se os usuários certos têm os acessos certos)
Relatório resumido de qualificação
Plataforma ou manual operacional e materiais de treinamento
Validações de aplicativos
Aplicativos (como Guias e Power Apps) que apoiam os processos empresariais em indústrias regulamentadas devem ser validados. Portanto, sua organização deve concluir as seguintes tarefas:
Avaliação inicial de risco
Plano de validação
Requisitos de usuário
Avaliação de risco
Especificação funcional do aplicativo ou especificação técnica de configuração
Testes (qualificação de instalação [IQ], qualificação operacional [OQ] e testes de aceitação do usuário [UAT]):
- Teste operacional (por exemplo, verificação de uma função)
- UAT
Matriz de rastreabilidade
Relatório de validação resumida
Manual de aplicação ou operacional e materiais de treinamento