Propósito de la validación y la trazabilidad
El propósito de la validación es garantizar que un proceso o sistema sea coherente y esté documentado. La validación del sistema es un requisito de las agencias reguladoras. Para las organizaciones de ciencias de la vida, por ejemplo, las agencias reguladoras incluyen la Administración de Alimentos y Medicamentos (FDA) de Estados Unidos.
La FDA define validación de la siguiente manera:
Confirmación mediante examen y suministro de pruebas objetivas de que los requisitos específicos para un uso previsto específico pueden cumplirse de manera coherente.
La Organización Mundial de la Salud (OMS) define validación de la siguiente manera en su guía sobre los requisitos de buenas prácticas de fabricación (GMP):
Establecimiento de pruebas documentales que proporcionen un alto grado de seguridad de que un proceso planificado será uniforme de acuerdo con los resultados especificados previstos.
Estas definiciones tienen en común los siguientes elementos, de acuerdo con los resultados previstos:
- Generación de pruebas
- Cumplimiento de la normativa
- Cumplimiento de los requisitos
La validación de los sistemas informatizados es un proceso documentado para garantizar que el sistema hace exactamente aquello para lo que ha sido diseñado de manera coherente y reproducible. La validación garantiza la integridad y seguridad del procesamiento de datos, la calidad del producto y el cumplimiento de la normativa que se aplican a las Prácticas adecuadas de {industry} (GxP).
El proceso de validar un sistema informatizado se describe en los procedimientos de operación normalizados (PON) y las pautas creadas y definidas por el sector regulado, como las organizaciones de ciencias de la vida. Para la validación de sistemas informatizados, resulta útil ver la implementación del proceso como un proyecto, como se describe en la Sociedad Internacional de Ingeniería Farmacéutica (ISPE) Buenas prácticas de fabricación automatizada (GAMP) 5: un enfoque basado en el riesgo para sistemas computarizados que cumplen con GxP.
Antes de comenzar el proyecto de implementación, se debe disponer de un plan general para la nueva solución. A continuación, comience el proyecto completando las siguientes fases:
- Planificación: en esta fase, los requisitos y especificaciones deben ser lo suficientemente claros para una evaluación de riesgo inicial y, en última instancia, para una definición correcta de las pruebas de verificación (protocolos). En esta fase, usted entrega el documento del plan de validación que define toda la estrategia de validación y todas las entregas. La estrategia debe estar de acuerdo con el sistema y las directivas de administración de la calidad (QMS).
- Especificación, configuración y codificación: durante esta fase se realizan todas las especificaciones de diseño con el nivel de detalle que se requiere según el tipo de sistema y su uso. Los desarrolladores eligen y utilizan los métodos y objetos de desarrollo que son más apropiados para los requisitos de codificación y configuración y en función de las especificaciones aprobadas. Todas estas actividades se realizan en el entorno de desarrollo. Durante esta fase, las pruebas se centran más en la verificación de las unidades o características desde la perspectiva del desarrollador. Algunos ejemplos de estas actividades de prueba pueden ser pruebas de la unidad, pruebas estadísticas de código y pruebas de integración. Las herramientas pueden automatizar estas actividades de prueba.
- Prueba: en esta fase se confirma que se han cumplido las especificaciones mediante inspecciones y pruebas del sistema. Las actividades de prueba se realizan en un entorno de prueba preparado y adecuado. El entorno de prueba debe parecerse al entorno de producción para garantizar que las condiciones son las mismas y evitar la repetición de las pruebas en el entorno de producción. El riesgo debe impulsar el ámbito de las actividades de prueba. El análisis de riesgos puede ayudarle a comprender los peligros potenciales que pueden tener un impacto en la calidad del producto, la seguridad del paciente o la integridad de los datos. Esos peligros potenciales deben mitigarse a través de la implementación de controles y la certificación de las pruebas. Si hay riesgos elevados en alguna parte, prepare escenarios de prueba adecuados que demuestren que el diseño de la solución no tiene errores potenciales.
- Informes y publicación: en esta fase, el sistema debe ser aceptable para su uso en el entorno de producción de acuerdo con un proceso documentado y controlado. Al cierre del proyecto, se debe preparar la validación del sistema para resumir las actividades que se realizaron y cualquier desviación respecto al plan de validación. La validación del sistema debe completarse antes de autorizar su uso.
En la siguiente ilustración se muestra el modelo V respaldado por GAMP 5, 2.ª edición. Ofrece una buena forma general de ver las fases del proyecto.
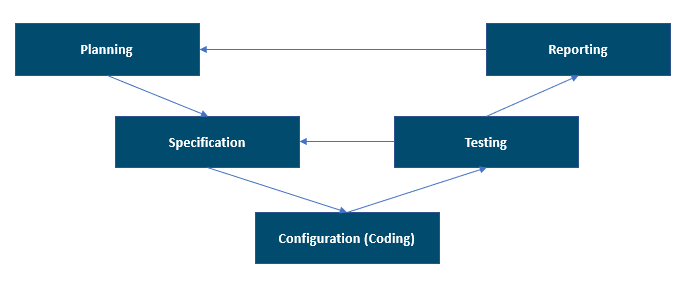
El modelo V puede considerarse no solo como las actividades de desarrollo y prueba del sistema, sino también su secuencia, sus interrelaciones y el proceso de validación de las entregas que se aplican al sistema informatizado validado. Debe mantener las interrelaciones entre requisitos, especificaciones y pruebas. Esta interrelación está documentada en la Matriz de trazabilidad que se utiliza en las áreas reguladas.
La Matriz de trazabilidad garantiza lo siguiente:
- Los requisitos se cumplen mediante el diseño de la solución. En otras palabras, se hace un seguimiento de cada requisito en las funciones, los controles, las configuraciones o los elementos de diseño.
- Los requisitos se prueban o verifican para demostrar que el diseño de la solución cumple los requisitos, según corresponda.
La Matriz de trazabilidad tiene las siguientes ventajas:
- Ayuda en la revisión del diseño.
- Ayuda a definir el ámbito de las pruebas de regresión.
- Brinda apoyo durante las actividades de inspección o auditoría.
- Proporciona apoyo para posibles cambios.
Calificación de la plataforma
Los sectores regulados deben calificar Microsoft Power Platform como infraestructura antes de implementar Guides. La calificación de la plataforma requiere como mínimo las siguientes tareas:
Evaluación inicial de riesgos (evaluación de la aplicabilidad de GxP)
Evaluación del proveedor (auditoría del proveedor: si es virtual, física o postal)
Plan de calificación
Especificación técnica del diseño de la plataforma
Evaluación de riesgos (por ejemplo, la evaluación del riesgo de que la versión incorrecta de una guía esté disponible para los operadores)
Pruebas:
- Pruebas de instalación (por ejemplo, probar que los entornos están correctamente instalados)
- Pruebas operativas (por ejemplo, probar que los usuarios correctos tengan los accesos adecuados)
Informe de resumen de calificación
Manual de la plataforma u operaciones, y material de formación
Validaciones de aplicaciones
Se deben validar las aplicaciones (como Guides y Power Apps) que respaldan los procesos de negocio en sectores regulados. Por lo tanto, su organización debe completar las siguientes tareas:
Evaluación inicial de riesgos
Plan de validación
Requisitos de usuario
Evaluación de riesgos
Especificación funcional de la aplicación o especificación técnica de la configuración
Pruebas (calificación de la instalación [IQ], calificación operativa [OQ] y pruebas de aceptación de usuario [UAT]):
- Pruebas operativas (por ejemplo, verificar una función)
- UAT
Matriz de trazabilidad
Informe de resumen de validación
Manual de la aplicación u operaciones, y material de formación